trypsinogeeniin
Määritelmä - Mikä on trypsinogeeni?
Trypsinogeeni on passiivinen edeltäjä, ns proentsyymistä, haimassa valmistettu entsyymi, nimeltään haima. Yhdessä jäljellä olevan haiman erityksen kanssa, ns. Haima, proentsyymi trypsinogeeni vapautuu haiman kanavien kautta pohjukaissuoleen, osaan ohutsuoleen. Tässä tapahtuu aktivaatio trypsiini-entsyymille.
Tätä entsyymiä kutsutaan "hydrolaasi"luokiteltu eli se pystyy jakamaan yhteydet yksittäisten aminohappojen välillä. Tämä prosessi tapahtuu Ohutsuoli sen sijaan, joka hajottaa proteiinit, jotka nautitaan ruoan kautta, pienemmiksi aminohappofragmentteiksi, mikä mahdollistaa niiden imeytymisen kehoon.

Kuinka aktivointi trypsiinille tapahtuu?
Trypsinogeenin aktivointi trypsiiniksi voi tapahtua kahdella eri tavalla. Molemmilla tavoilla aktivoitumista ei tapahdu haiman tai sen kanavien alueella, vaan vain pohjukaissuolen alueella, joka on osa ohutsuolesta.
- Toista entsyymiä tarvitaan yhdelle aktivointimahdollisuudelle trypsiinille. Tätä entsyymiä tuotetaan pohjukaissuolen harjan reunassa, ts. Pinnallisissa soluissa. Sitä kutsutaan enteropeptidaasiproteiinien tai enterokinaasikohta. Entsyymi kuuluu hydrolaasit luokiteltu. Tämä tarkoittaa, että ne voivat palautettavasti pilkkoa yksittäisten aminohappojen yhdisteet, jotka antavat proentsyymin trypsinogeenille sen rakenteen, kuluttamalla vesimolekyylejä. Kun trypsinogeeni aktivoidaan trypsiiniksi, kuuden aminohapon ketju, ns. Heksapeptidi, erotetaan proentsyymin trypsinogeenistä vettä kuluttaen. Tämä luo lyhennetyn aminohappoketjun aiempaan verrattuna. Prosessia kutsutaan rajoitettu proteolyysi. Entsyymi on kuitenkin nyt aktiivisessa muodossaan ja se voi jakaa lisää aminohappoketjuja proteiinien hajottamiseksi ja sulattamiseksi.
- Toista vaihtoehtoa aktivoida trypsinogeeni trypsiiniksi edustaa jo aktiivinen entsyymi trypsiini. Trypsiini ei vain jaa vieraita proteiineja pienemmiksi aminohappoketjuiksi, vaan se voi myös lyhentää kehon omia entsyymejä, kuten trypsinogeeniä, useilla aminohapoilla. Erityisesti trypsiini haluaa jakaa trypsinogeenin kuudennen aminohapon jälkeen. Tämä tarkoittaa, että heksapeptidi hajoaa, mikä muuntaa trypsinogeenin aktiiviseen muotoonsa, trypsiiniksi. Trypsinogeenin lisäksi aktiivinen trypsiini voi muuntaa kolme muuta entsyymiä, jotka ovat tärkeitä ruuansulatuksessa, aktiiviseen muotoonsa. Kaksi tekijää, jotka eivät alun perin ole ilmeisiä, ovat myös tärkeitä aktivoinnille. Yhtäältä trypsiinin vaikutus on erityisen hyvä hieman pH-arvon ollessa 7 - 8, mikä tarkoittaa, että trypsinogeeni aktivoituu yhä enemmän. Toisaalta trypsinogeeni vapautuu haimassa trypsiini-inhibiittorin avulla. Tämä estää ennenaikaisen aktivoitumisen haimassa ja hajoaa vain pohjukaiskaisessa.
Missä trypsinogeeniä valmistetaan?
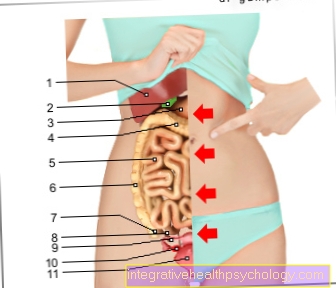
Proentsyymin trypsinogeeni on formuloitu karkeasti haimassa. Tämä valhe vatsan yläosassa vasemmalla puolella vatsaa. Haima voidaan edelleen jakaa kahteen osaan:
- Niistä endokriiniset osat tuottaa hormoneja kuten insuliini kehon sisällä toimivan sokeritasapainon säätelemiseksi.
- Niistä eksokriininen osajoka muodostaa haiman suurimman osan, tuottaa haiman, joka on proenyymi trypsinogeeniin ja sillä on tärkeä rooli ruuansulatuksessa.
Saatat olla myös kiinnostunut: Haiman toiminnot
Mitkä ovat normaaliarvot?
Koska trypsinogeeni kulkee normaalisti haiman kanavien kautta suoraan ohutsuoleen, veressä ei yleensä ole trypsinogeeniä, mikä tarkoittaa, että normaaliarvot lähestyvät nollaa.
Jos veressä havaitaan trypsinogeeni, havainto puhuu ehdottomasti patologisesta prosessista. Tässä tulee esimerkiksi akuutti haimatulehdus ja a Kystinen fibroosi kysymyksessä. Trypsiini testataan osana vastasyntyneen seulontaa.
Mitä tekemistä trypsinogeenillä on kystisen fibroosin kanssa?
Kystisessä fibroosissa, jota kutsutaan myös kystiseksi fibroosiksi, genomin mutaatio muuttaa muutosta rauhasten erityksen koostumuksessa, jotka vapauttavat niiden erityksen kehon pintaan, kuten suolen. Erityksestä tulee huomattavasti viskoosimpaa, mikä tarkoittaa, että se voi vapautua hitaammin.
Tämä on erityisen kriittistä haiman tapauksessa. Haiman käytävissä pidemmän viipymisajan vuoksi erityksellä on lisääntynyt vaikutus elimessä. Koska trypsinogeeni aktivoituu myös yhä enemmän trypsiiniksi, tapahtuu oman kehon sulamista, mikä voi johtaa akuuttiin haimatulehdukseen.
Lisätietoja aiheesta löytyy täältä: Kystinen fibroosi
Mikä on trypsiini?
Trypsiini on entsyymi, joka syntyy passiivisesta esiasteesta, proentsyymistä trypsinogeenistä, ja sillä on tärkeä rooli proteiinien sulamisessa. Proentsyymi trypsinogeeni tulee haiman eksokriinisestä osasta. Tämä proentsyymi aktivoidaan kahdella eri tavalla. Toisaalta enteropeptidaasi-entsyymin avulla aminohappoketju, joka koostuu kuudesta aminohaposta, jaetaan. Toisaalta trypsiini voi aktivoida itsensä. Tässäkin kuudesta aminohaposta koostuva aminohappoketju jaetaan. Aktiivinen trypsiini voi myös tehdä kolme proentsyymiä Procarboxypeptidases, Proaminopeptidases ja kymotrypsiininumerointi muuntuvat niiden kolmeksi aktiiviseksi entsyymiksi jakamalla aminohappoketju. Nämä kolme entsyymiä osallistuvat myös proteiinien hajottamiseen.
Trypsiini luokitellaan entsyymiksi luokkaan hydrolaasit luokiteltu. Tämä tarkoittaa, että ne voivat palautettavasti jakaa yhteydet aminohappojen välillä vettä kuluttamalla. Kyky jakaa aminohappoketjut saavuttaa maksimiarvon lievästi emäksisissä haimassa pH-arvojen ollessa 7 - 8. Tämä ominaisuus on välttämätön ruoansulatusprosessissa.
Suun sylkessä olevien entsyymien jälkeen trypsiini edustaa proteiinien pilkkomisen toista vaihetta. Entsyymi ei pilkkoa proteiinien aminohappoketjua ulkopuolelta, vaan jakaa pikemminkin koko ketjun useisiin pieniin fragmentteihin, joita sitten muut lyhentävät muut entsyymit siten, että ne ovat voi imeytyä kehoon suolen limakalvon kautta.
Lisätietoja löytyy täältä: Trypsiini
Mitä tapahtuu trypsiinivajeelle?
Trypsiinin puutteen vuoksi proteiinien sulaminen on häiriintynyt. Seuraavassa kehoon imeytyy vähemmän aminohappoja. Koska jotkut aminohapot ovat välttämättömiä ihmiskeholle, koska niitä ei voida tuottaa joko muuttamalla olemassa olevia aminohappoja tai omalla synteesillä, puutosoireet ilmenevät hetken kuluttua, joilla hoitamatta jättämisellä voi olla vakavia seurauksia.
Lisäksi voi tapahtua, että kehon aminohappovarastoja, kuten lihasten proteiineja, käytetään, mikä johtaa painonpudotukseen ja heikentyneeseen joustavuuteen.
Alfa-1 antitrypsiinin puute
Alfa-1-antitrypsiinin puutos johtuu usein geneettisestä vikasta. Alfa-1-antitrypsiini on entsyymi, joka estää muiden entsyymien toimintaa. Prosessissa estettyjen entsyymien tehtävänä on normaalisti hajottaa proteiineja, jolloin ne menettävät toimintansa. Siten Alfa-1-antitrypsiiniä voidaan myös käyttää Proteinaasinestäjä on nimetty.
Alfa-1-antitrypsiinin estämät entsyymit esiintyvät pääasiassa tulehduksellisissa prosesseissa ja ovat pääasiassa Kymotrypsiini, trypsiini, plasmiini, elastaasi ja trombiini.
Elastaasin estämisellä on tässä erityinen merkitys. Elastaasi hajottaa pääsääntöisesti elastiinin, jota esiintyy pääasiassa keuhkoissa. Elastiini on rakenteellinen proteiini, joka on suurelta osin vastuussa keuhkojen joustavuudesta. Jos elastaasi-inhibiittoreista, kuten alfa-1-antitrypsiinistä, puuttuu, tämä voi johtaa elastaasin lisääntyneeseen aktiivisuuteen keuhkoissa. Täällä, kuten kaikkialla muualla kehossa, elastaasi hajottaa proteiineja, mutta tämä vaikuttaa kehon omaan keuhkoihin. Tämä johtaa massiiviseen vaurioon keuhkokudoksessa, mikä väistämättä rajoittaa keuhkojen toimintaa. Siitä kehittyviä oireita ovat Yskä, hengenahdistus ja hengitysteiden supistuminen. Lisäksi maksassa, joka on pääasiassa vastuussa elastaasin tuotannosta, voi olla kohonnut maksa-arvo ja sitä voidaan vahingoittaa edelleen sappitukokset.
Lisätietoja löytyy täältä: Alfa-1 antitrypsiinin puute
Toimituksemme suositukset
- trypsiini
- Alfa-1 antitrypsiini
- Alfa-1 antitrypsiinin puute
- Kymotrypsiini - mistä se on tärkeää?
- Entsyymien rooli ihmiskehossa

.jpg)