Entsyymit
määritelmä
Entsyymit ovat kemiallisia aineita, joita löytyy koko kehosta. Ne käynnistävät kemialliset reaktiot kehossa.
historia
Sana entsyymi teki Wilhelm Friedrich Kühne 1878 ja on johdettu kreikkalaisesta muodostetusta sanasta entsyymoni, joka tarkoittaa hiivaa tai hapanta. Tämä löysi tiensä kansainväliseen tieteeseen. puhtaan sovelletun kemian kansainvälinen liitto (IUPAC) ja biokemian kansainvälinen liitto (IUBMB) kehitti yhdessä entsyymien nimikkeistön, joka määrittelee tämän suuren aineryhmän edustajat yhteiseksi ryhmäksi. Nimeäminen, joka luokittelee entsyymit tehtäviensä mukaan, on tärkeä yksittäisten entsyymien tehtävien määrittämisessä.
Kuva entsyymeistä
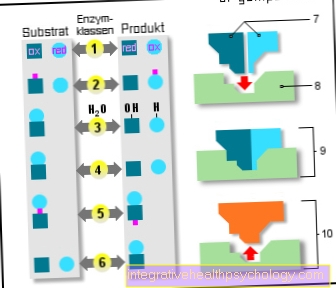
Entsyymit
6 entsyymiluokkaa:
- Oksidoreduktaasit
(Hapetus / pelkistys) - Transferaasit
(Tarttuminen) - Hydrolaasit
(Veden käyttö) - Lyases
(Pilkkominen) - Isomeraasit
(sama empiirinen kaava) - Ligaasit
(Lisäysreaktiot) - Alustat
- Aktiivinen keskus
- Entsyymi / substraatti
monimutkainen - Entsyymi / tuote
monimutkainen
Yleiskatsaus kaikistaDr-Gumpertin kuvat löytyvät osoitteesta: lääketieteelliset kuvat
Nimeäminen
Nimeäminen entsyymi on päällä kolme perusperiaatetta perustuu. Entsyymien nimet, jotka päättyvät –ase kuvaavat useita entsyymejä järjestelmässä. Entsyymin nimi kuvaa itse reaktion, jonka entsyymi saa liikkeelle (katalysoitu). Entsyymin nimi on myös entsyymin luokitus. Lisäksi koodijärjestelmä, joka EY-numerojärjestelmä, jossa entsyymit valmistetaan numeerisella koodilla neljä numeroa voidaan löytää. Ensimmäinen numero osoittaa entsyymiluokan. Luettelot kaikista havaituista entsyymeistä varmistavat, että määritelty entsyymikoodi löytyy nopeammin. Vaikka koodit perustuvat entsyymin katalysoimien reaktioiden ominaisuuksiin, käytännössä numeeriset koodit osoittautuvat hankaliksi. Edellä mainittuihin sääntöihin perustuvia järjestelmällisiä nimiä käytetään useammin. Nimikkeistön ongelmia syntyy esimerkiksi entsyymien kanssa, jotka katalysoivat useita reaktioita. Siksi heille on joskus useita nimiä. Joillakin entsyymeillä on triviaalit nimet, jotka eivät osoita, että mainittu aine on entsyymi. Koska nimiä on perinteisesti käytetty laajasti, osa niistä on säilynyt.
Luokitus entsyymitoiminnan mukaan
IUPAC: n ja IUBMB: n mukaan entsyymit jaetaan kuuteen entsyymiluokkaan niiden käynnistämän reaktion mukaan:
- Oksidoreduktaasit
Oksidoreduktaasit panevat redoksireaktiot liikkeelle. Tässä kemiallisessa reaktiossa elektronit siirtyvät yhdestä reaktiokumppanista toiseen. Yksi aine vapauttaa elektroneja (hapetus) ja toinen aine hyväksyy elektroneja (pelkistys).
Katalysoidun reaktion kaava on A + B + A + B +.
Aine A vapauttaa elektronin (?) Ja hapetetaan, kun taas aine B absorboi tämän elektronin ja pelkistyy. Siksi redoksireaktioita kutsutaan myös pelkistys-hapetusreaktioiksi.
Monet metaboliset reaktiot ovat redox-reaktioita. Oksenaasit siirtävät yhden tai useamman happiatomin substraatilleen. - Transferaasit
Transferaasit siirtävät funktionaalisen ryhmän substraatista toiseen. Funktionaaliset ryhmät ovat orgaanisten yhdisteiden atomiryhmiä, jotka määrittävät aineen ominaisuudet ja reaktiokäyttäytymisen suuressa määrin. Kemialliset yhdisteet, joilla on samat toiminnalliset ryhmät, on ryhmitelty aineluokkiin niiden samankaltaisten ominaisuuksien vuoksi. Funktionaaliset ryhmät jaetaan sen mukaan, ovatko ne heteroatomeja vai eivät. Heteroatomit ovat kaikki orgaanisten yhdisteiden atomeja, jotka eivät ole hiiltä eivätkä vetyjä.
Esimerkki: -OH -> hydroksyyliryhmä (alkoholit) - Hydrolaasit
Hydrolaasit jakavat sidokset palautuvissa reaktioissa käyttäen vettä. Esterit, esterit, peptidit, glykosidit, happoanhydridit tai C-C-sidokset. Tasapainoreaktio on: A-B + H20? A-H + B-OH.
Hydrolaasien ryhmään kuuluva entsyymi on esimerkiksi alfa-galaktosidaasi. - Lyases
Lyaasit, joita kutsutaan myös syntaaseiksi, katalysoivat monimutkaisten tuotteiden pilkkomisen yksinkertaisista substraateista jakamatta ATP: tä. Reaktiokaavio on A-B → A + B.
ATP on adenosiinitrifosfaatti ja nukleotidi, joka koostuu nukleosidiadenosiinin trifosfaatista (ja sellaisenaan nukleiinihappo-RNA: n energiarikkaana rakennuspalikkana). ATP on kuitenkin lähinnä jokaisessa solussa välittömästi saatavissa olevan energian yleismaailmallinen muoto ja samalla tärkeä energiantoimitusprosessien säätelijä. Tarvittaessa ATP syntetisoidaan uudelleen muista energiavarastoista (kreatiinifosfaatti, glykogeeni, rasvahapot). ATP-molekyyli koostuu adeniinitähteestä, sokeririboosista ja kolmesta fosfaatista (a-α) esterissä (a) tai anhydridisidoksissa (a ja β). - Isomeraasit
Isomeraasit nopeuttavat isomeerien kemiallista konversiota. Isomerismi on kahden tai useamman kemiallisen yhdisteen esiintyminen, joilla on täsmälleen samat atomit (sama empiirinen kaava) ja molekyylipainot, jotka kuitenkin eroavat atomien yhteydestä tai spatiaalisesta järjestelystä. Vastaavia yhdisteitä kutsutaan isomeereiksi.
Nämä isomeerit eroavat toisistaan kemiallisilla ja / tai fysikaalisilla ominaisuuksillaan ja usein myös biokemiallisilla ominaisuuksillaan. Isomeria esiintyy pääasiassa orgaanisten yhdisteiden kanssa, mutta myös (epäorgaanisten) koordinaatioyhdisteiden kanssa. Isomerismi on jaettu eri alueille. - Ligaasit
Ligaasit katalysoivat sellaisten aineiden muodostumista, jotka ovat kemiallisesti monimutkaisempia kuin käytetyt substraatit, mutta toisin kuin lyaasit, ovat entsymaattisesti tehokkaita vain ATP-pilkkomisen yhteydessä. Näiden aineiden muodostuminen vaatii siis energiaa, joka saadaan jakamalla ATP.
Jotkut entsyymit pystyvät katalysoimaan useita, joskus hyvin erilaisia reaktioita. Jos näin on, ne luokitellaan useisiin entsyymiluokkiin.
Saatat myös olla kiinnostunut näistä artikkeleista:
- Alfa-glukosidaasi
- Lipaasi
- Trypsiini
Luokitus entsyymirakenteen mukaan
Lähes kaikki entsyymit ovat proteiineja, ja ne voidaan luokitella proteiiniketjun pituuden perusteella:
- Monomeerit
Entsyymit, jotka koostuvat vain yhdestä proteiiniketjusta - Oligomeerit
Entsyymit, jotka koostuvat useista proteiiniketjuista (monomeerit) - Useat entsyymiketjut
Useat yhdistetyt entsyymit, jotka toimivat yhteistyössä ja säätelevät toisiaan. Nämä entsyymiketjut katalysoivat peräkkäisiä vaiheita solun aineenvaihdunnassa.
Lisäksi on olemassa yksittäisiä proteiiniketjuja, jotka sisältävät useita entsyymiaktiivisuuksia; näihin viitataan monitoimisina entsyymeinä.
Luokitus kofaktoreiden mukaan
Toinen luokitus on luokittelu kofaktoreiden harkinnan mukaan. Kofaktorit, koentsyymit ja apusubstraatit ovat nimiä aineille, jotka vaikuttavat biokemiallisiin reaktioihin vuorovaikutuksessa entsyymien kanssa.
Orgaaniset molekyylit ja ionit (enimmäkseen metalli-ionit) otetaan huomioon.
Puhtaat proteiinientsyymit koostuvat yksinomaan proteiineista, ja aktiivinen keskus muodostuu vain aminohappotähteistä ja peptidirungosta. Aminohapot ovat orgaanisten yhdisteiden luokka, jossa on vähintään yksi karboksiryhmä (-COOH) ja yksi aminoryhmä (-NH2).
Holoentsyymit koostuvat proteiinikomponentista, apoentsyymistä, ja kofaktorista, pienen molekyylipainon omaavasta molekyylistä (ei proteiinista). Molemmat yhdessä ovat tärkeitä entsyymin toiminnalle.
Koentsyymit
Orgaanisia molekyylejä kofaktoreina kutsutaan koentsyymeiksi. Jos ne ovat kovalenttisesti sitoutuneet apoentsyymiin, niitä kutsutaan proteesiryhmiksi tai rinnakkaissubstraateiksi. Proteesiryhmä viittaa ei-proteiinikomponentteihin, jotka ovat sitoutuneet tiukasti (enimmäkseen kovalenttisesti) proteiiniin, jolla on katalyyttinen vaikutus.
Kosubstraatit ovat nimiä aineille, jotka vaikuttavat biokemiallisiin reaktioihin vuorovaikutuksessa entsyymien kanssa. Biokatalyytteinä molekyylit nopeuttavat reaktioita organismeissa, entsyymit nopeuttavat biokemiallisia reaktioita. Ne vähentävät aktivointienergiaa, joka on voitettava, jotta aine voidaan muuntaa.