Bextra®
Selitys / määritelmä
Bextra® - kuten Celebrex® - kuuluvat ei-steroidisten tulehduskipulääkkeiden (NSAID) ryhmään. Hyvän kivunlievityksen lisäksi sillä on myös anti-inflammatorinen teho.
Bextra® kuuluu uusien COX-2-estäjien ryhmään, myös siihen ryhmään, johon Vioxx® kuului, lääke, joka vedettiin markkinoilta 30. syyskuuta 2004 sydän- ja verisuonijärjestelmän sivuvaikutusten vuoksi.
Kauppanimi / valmistaja
Bextra® 10 mg kalvopäällysteiset tabletit
Bextra® 20 mg kalvopäällysteiset tabletit
Bextra® 40 mg kalvopäällysteiset tabletit
Valmistaja: Pfizer ®
Merkintä
Haluamme huomauttaa, että Bextra® johtuu sivuvaikutuksista Sydän ja verisuoni vedettiin markkinoilta 04.7.2005.
Kemiallinen nimi / molekyylikaava
4- (5-metyyli-3-fenyyli-4-isoksatsolyyli) bentseenisulfonamidi
C16H14N2O3S
Vaikuttava aine: valdekoksibi
sovellusalueet
Tyypillisiä Bextra®-sovellusalueita ovat:
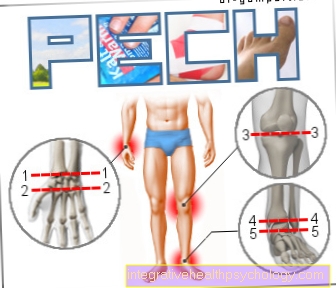
- nivelrikko
- Nivelreuma
- Kuukautiskrampit (dysmenorrhea)
vaikutus
Kaikki tulehduskipulääkkeet estävät endogeenistä entsyymiä, ns. Syklo-oksigenaasia. Tällä entsyymillä on avainrooli prostaglandiinien muodostumisessa. Tämän syklo-oksigenaasin kaksi luokkaa (COX-1 ja COX-2) erotetaan toisistaan.
Prostaglandiinit ovat ns. Kivun välittäjiä, jotka säätelevät kipuja, tulehduksia ja kuumeita. Prostaglandiinit vaikuttavat myös veren hyytymiseen.
Bextra on uuden anti-inflammatoristen lääkkeiden luokan jäsen; se on selektiivinen syklo-oksigenaasi 2 (COX-2) -inhibiittori. Tämä tarkoittaa sitä, että se estää pääasiassa kipua ja turvotusta aiheuttavaa COX-2: ta, kun taas se estää COX-1: tä, joka on s.o. Säännelty vatsan suojaamiseksi, estää vain hiukan.
Yhteenvetona voidaan todeta, että COX-2-estäjät ovat hyvä tapa hoitaa selektiivisemmin. On edelleen nähtävissä, johtaako tämä valikoiva terapia lisääntyneeseen sivuvaikutusten riskiin (erityisesti sydänkohtaukseen ja aivohalvaukseen).
annostus
Bextra ® on saatavana annoksina 10 mg, 20 mg ja 40 mg. Suurin päivittäinen annos annetaan kerta-annoksena 40 mg.
Sivuvaikutukset
Rajoitamme luettelossa yleisimpiä sivuvaikutuksia. Koska jokainen henkilö reagoi lääkitykseen erikseen, haittavaikutuksia, joita ei ole mainittu, voi tietysti esiintyä.
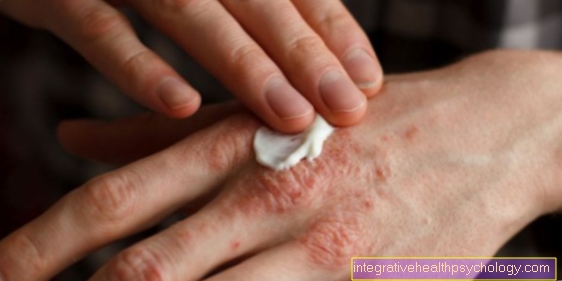
Allerginen reaktio:
- Ihottuma (punoitus, kutina)
- Verenpaineen lasku
- shokki
Ruoansulatuskanavan valitukset
huimaus, väsymyson tarvittaessa aktiivinen osallistuminen Tieliikenne ei ole enää mahdollista.
Vedenpidätys kudoksessa (turvotus)
Laboratorion muutokset
- Maksaentsyymiarvojen nousu veressä
- Punasolujen määrän väheneminen
vuorovaikutukset
antikoagulantti:
- Bextra®-valmistetta ei tule antaa samanaikaisesti antikoagulanttivalmisteiden tai saman luokan vaikuttavien aineiden (diklofenaakki / indometatsiini / piroksikaami / ibuprofeeni) valmisteiden kanssa.
Varsinkin kun Marcumar ® annetaan samanaikaisesti, on otettava huomioon, että Marcumar ®: n verta ohentava vaikutus kasvaa.
Vaikutus verenpainelääkkeet (ACE-estäjät, beeta-salpaajat, diureetit) voivat heikentyä.
Vasta
Et saa Bextra® jos:
- olet raskaana tai haluat tulla raskaaksi
- imetys
- joilla on jo ollut allerginen reaktio johonkin Bextra®-kapselien komponentteihin
- heillä on jo ollut allerginen reaktio “sulfonamidien” lääkeryhmän lääkkeille (joita käytetään muun muassa antibiootteina virtsarakon tulehduksissa).
- ottamisen jälkeen aspiriini tai muut ei-steroidiset anti-inflammatoriset aineet (Tulehduskipulääkkeet) kuten esimerkiksi ibuprofeeni on esiintynyt allergisia reaktioita, kuten ihottumaa, turvotusta, kutinaa tai hengenahdistusta
- kärsivät tulehduksellisesta suolistosairaudesta
- Mahahaava ja / tai sinulla on pohjukaissuolihaava (haavauma)
- sinulla on vaikeita maksa- ja munuaisongelmia
- erittäin vaikea Sydämen vajaatoiminta (dekompensoitu sydämen vajaatoiminta)
hinta
Koska terveydenhuoltoalalla puhutaan aina kustannuspaineista, mielestäni on tärkeää selvittää myös lääkkeiden hinnat:
Bextra 10 mg 10 kalvotablettia (N1) 21,63 euroa
Bextra 20 mg 100 kalvotablettia (N3) 134,71 euroa
Tila: tammikuu 2004
Bextra-valmisteen eurooppalainen hyväksyntä on vanhentunut vuodesta 2005.




.jpg)